Ley de Boyle-Mariotte
Para una cierta cantidad de gas a temperatura constante, su presión es inversamente proporcional al volumen que ocupa.
Matemáticamente sería:
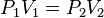
p..-2v=p5-v
[editar]Ley de Charles
A una presión dada, el volumen ocupado por una cierta cantidad de un gas es directamente proporcional a su temperatura.
Matemáticamente la expresión sería:
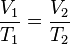 o
o 
[editar]Ley de Gay-Lussac
La presión de una cierta cantidad de gas, que se mantiene a volumen constante, es directamente proporcional a la temperatura:
Es por esto que para poder envasar gas, como gas licuado, primero se ha de enfriarse el volumen de gas deseado, hasta una temperatura característica de cada gas, a fin de poder someterlo a la presión requerida para licuarlo sin que se sobrecaliente, y, eventualmente, explote.
[editar]Ley de Avogadro
A presión y temperatura constantes, el volumen de cualquier gas es directamente proporcional al número de moles del mismo. O alternativamente, volúmenes iguales de gases diferentes, pero a las mismas presión y temperatura, contienen el mismo número de moléculas.
Matemáticamente, la fórmula es:
[editar]Ley de los gases ideales
Las tres leyes mencionadas pueden combinarse matemáticamente en la llamada ley general de los gases. Su expresión matemática es:
siendo P la presión, V el volumen, n el número de moles, R la constante universal de los gases ideales y T la temperatura en Kelvin.
El valor de R depende de las unidades que se estén utilizando:
- R = 0,082 atm·l·K−1·mol−1 si se trabaja con atmósferas y litros
- R = 8,31451 J·K−1·mol−1 si se trabaja en Sistema Internacional de Unidades
- R = 1,987 cal·K−1·mol−1
- R = 8,31451 10−10 erg ·K−1·mol−1
De esta ley se deduce que un mol de gas ideal ocupa siempre un volumen igual a 22,4 litros a 0 °C y 1 atmósfera. Véase también Volumen molar. También se le llama la ecuación de estado de los gases, ya que sólo depende del estado actual en que se encuentre el gas.


No hay comentarios:
Publicar un comentario